Odmiany Alotropowe Węgla
Witaj na mojej stronie, poświęconej tematowi odmian alotropowych węgla. Węgiel, ze względu na swoje unikalne właściwości chemiczne i fizyczne, występuje w różnych formach, znanych jako alotropy. Poniżej przedstawiam główne odmiany alotropowe węgla.
Grafit
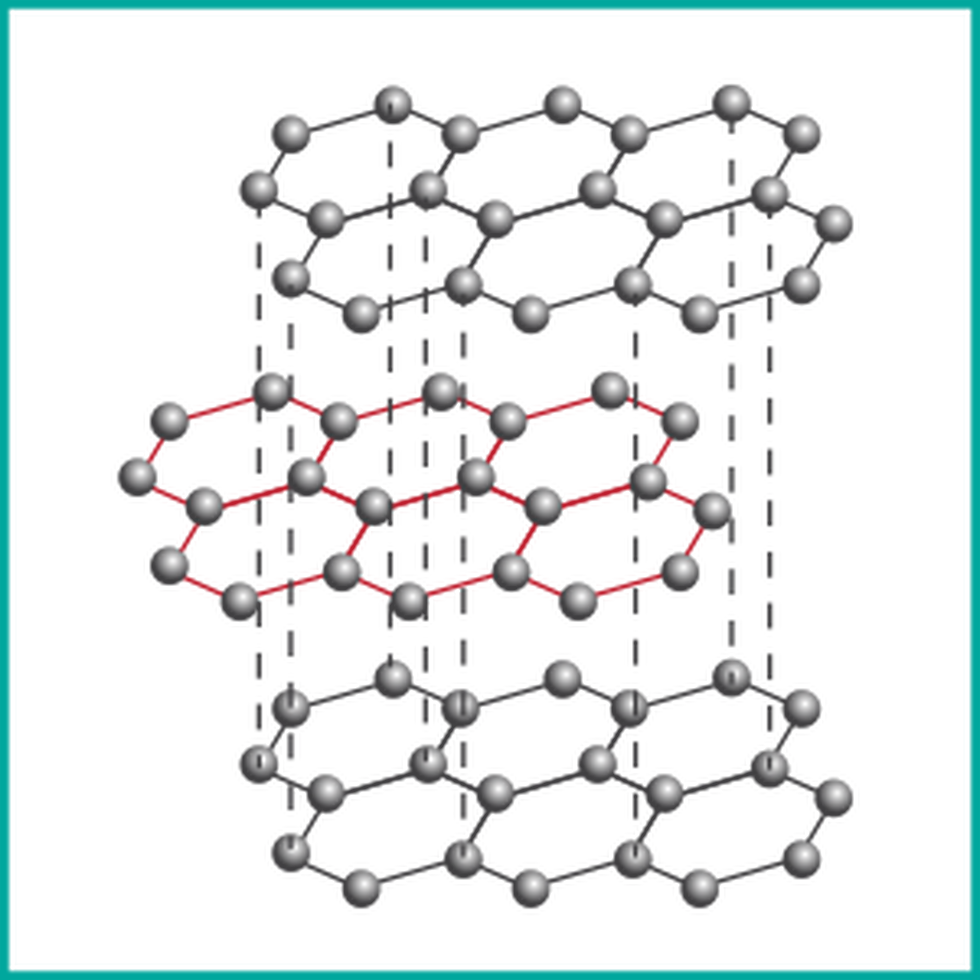
Grafit to jedna z najbardziej znanych odmian alotropowych węgla. Charakteryzuje się warstwową strukturą, w której atomy węgla tworzą płaskie sześcienne pierścienie. Pomiędzy warstwami występują siły van der Waalsa, co sprawia, że warstwy są łatwo przesuwane względem siebie. Dzięki temu grafit posiada właściwości smarujące i jest używany m.in. do produkcji ołówków.
Zastosowanie
Krystaliczny grafit płatkowy jest wykorzystywany do produkcji elektrod węglowych, szczotek i płyt potrzebnych w akumulatorach suchych ogniw i przemyśle elektrycznym.
Właściwości fizyczne:
- -substancja stała, miękka, tłusta w dotyku
- -ciemnoszare płytki, nierozpuszczalne w wodzie
- -dobrze przewodzi prąd elektryczny i ciepło
Właściwości chemiczne:
- -bezwonny
- -mało aktywny chemicznie w temperaturze 0℃; w podwyższonej temperaturze reaguje m.in. z Br2
- -ulega reakcjom spalania
Diament

Diament to inna popularna forma alotropowa węgla. W przeciwieństwie do grafitu, diament ma bardzo gęstą strukturę krystaliczną, gdzie każdy atom węgla jest połączony z czterema sąsiadami w regularnym trójwymiarowym układzie. Ta struktura nadaje diamentowi twardość, sprawiając, że jest jednym z najtwardszych znanych materiałów.
Zastosowanie
Diamenty są stosowane przy produkcji materiałów ściernych, do wyrobu past termoprzewodzących, jako elementy w aparaturze naukowej i medycznej i jako detektory cząstek elementarnych, dozymetry.
Właściwości fizyczne:
- -substancja stała, krucha
- -zwykle bezbarwne kryształy
- -nie przewodzi prądu elektrycznego
- -dobrze przewodzi ciepło
Właściwości chemiczne:
- -bezwonny
- -zwykle bezbarwne kryształy
- -mało aktywny chemicznie, spala się w temperaturze wyższej od 850℃
- -w podwyższonej temperaturze reaguje m.in. z F2
Fulereny

Fulereny to grupa alotropów węgla, odkrytych stosunkowo niedawno. Są to struktury zbudowane z pierścieni węglowych, tworzące kształty kuliste, elipsoidalne lub rurki. Najbardziej znanym fulerenem jest C60, znany również jako buckyball. Fulereny mają liczne zastosowania w nanotechnologii i elektronice.
Zastosowanie
Ze względu na swoje właściwości, fulereny stosowane są w technice biomedycznej, optycznej oraz elektronicznej. Fulereny wchodzą też w skład katalizatorów oraz innych urządzeń przemysłu chemicznego.
Właściwości fizyczne:
- -substancje stałe o metalicznym połysku
- -kryształy o barwie od żółtej do czerwonobrązowej
- -nierozpuszczalne w wodzie, rozpuszcza się w rozpuszczlnikach organicznych
- -mają właściwości nadprzewodzące i półprzewodnikowe
Właściwości chemiczne:
- -bezwonny
- -pod wpływem światła ulegają rozpadowi
- -reagują z najaktywniejszymi litowcami
- -ulegają reakcją spalania
Grafen

Jest to jednowarstwowy płaski układ atomów węgla ułożonych w strukturę heksagonalną, co nadaje mu wyjątkowe właściwości. Oto kilka kluczowych cech grafenu: przewodnictwo elektryczne, przewodnictwo cieplne, przeźroczystość
Zastosowanie
Grafen może być wykorzystywany do produkcji ogniw fotowoltaicznych, ekranów i paneli dotykowych możliwych do zwijania w rolkę oraz świateł LED.
Właściwości fizyczne:
- -substancja stała, wytrzymała mechanicznie
- -przezroczysty
- -nierozpuszczalny w wodzie
- -dobrze przewodzi prąd elektryczny i ciepło
Właściwości chemiczne:
- -bezwonny
- -mało aktywny chemicznie
- -w wyniku reakcji z wodorem staje się izolatorem
Cyklokarbon
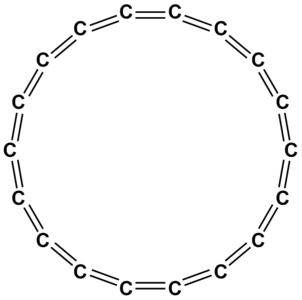
Cyklokarbon jest to alotropowa odmiana węgla o strukturze cząsteczkowej (podobnie jak fuleren). Ma strukturę pierścienia złożonego z 18 atomów węgla, w którym naprzemiennie występują wiązania potrójne i pojedyncze.
Zastosowanie
Badania nad strukturą cyklokarbonu sugerują, że działa ona jak półprzewodnik, co oznacza, że ma potencjalne zastosowanie w elektronice.Dzięki takim materiałom możliwe byłoby stworzenie choćby atomowej wielkości bramek logicznych czy tranzystorów. A dzięki temu - dalsze postępy w zakresie miniaturyzacji urządzeń elektronicznych.




